Основания — это соединения, которые поглощают протоны во время химических реакций. В водных растворах они образуют гидроксид-ионы и, следовательно, оказывают сильное коррозионное действие.
Наиболее важными неорганическими основаниями являются гидроксид натрия, гидроксид калия, аммиак и гидроксиды щелочноземельных металлов кальция и бария.
Эти элементы и их водные растворы (щелочи), используются не только в промышленности и технике, но также являются компонентами многих потребительских товаров повседневной жизни.
Основания являются важными исходными материалами для производства стекла, целлюлозы, удобрений и строительных материалов.
Неорганические основания наносят значительный ущерб окружающей среде, если попадают в окружающую среду и нарушают баланс pH воды.
В воде основания образуют гидроксид-ионы.
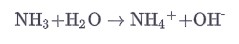
Гидроксиды металлов представляют собой ионные соединения, решетка которых состоит из катионов металлов и гидроксид-ионов. Гидроксиды щелочей очень хорошо растворяются в воде и являются сильными основаниями.
В зависимости от концентрации гидроксид-ионов некоторые основания могут быть очень агрессивны. Поэтому неосторожное обращение со щелочами может привести к несчастным случаям.
Едкий натр
Гидроксид натрия (NaOH) представляет собой белое кристаллическое вещество, называемое едким натром.
Соединение негативно действует на кожу, слизистые оболочки и вызывает коррозию глаз.
Гидроксид натрия хорошо растворяется в воде и спирте. Реакция идет с выделением тепла. Это гигроскопичное (поглощающее влагу) вещество.
Твердый гидроксид натрия реагирует с углекислым газом воздуха с образованием карбоната натрия, поэтому его следует хранить в плотно закрытой таре.
Эта реакция используется в анализе органических элементов путем связывания диоксида углерода, образующегося при сжигании, с кальцинированной содой.
Гидроксид натрия является составным элементом раствора хлорида натрия (физиологический раствор).
Наиболее важным в промышленности процессом является хлорно-щелочной электролиз, при котором едкий натр и хлор используются для производства двух очень важных материалов для химической промышленности: хлора и водорода.
При электролизе хлорид окисляется до хлора на аноде из титана, а водород образуется на железном катоде.
В водном растворе остаются ионы натрия.
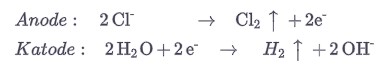
Ионы натрия присутствуют в растворе, но не участвуют в реакции:
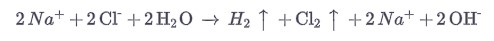
Другим направлений является извлечение алюминия из боксита.
Оксид алюминия может быть растворен с помощью концентрированного гидроксида натрия в форме растворимого тетрагидроксоалюминатного комплекса боксита и, таким образом, отделен от других оксидов.
Для производства бумаги и целлюлозы из дерева или для производства мыла и красителей каустическая сода является незаменимым вспомогательным химическим веществом, которое играет важную роль в процессах конверсии, обработки и очистки.
Гидроксид калия
Как и гидроксид натрия, гидроксид калия является ионным соединением. Соединение легко растворяется в воде.
Его водный раствор (едкий калий) имеет свойства, сходные с едким натром из-за его сильного воздействия на кожу, слизистые оболочки и глаза.
Ранее гидроксид калия получали взаимодействием калия (карбонат калия) с гашеной известью (гидроксид кальция):
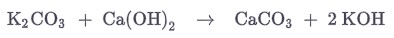
Сегодня едкий калий получают с помощью хлорно-щелочного электролиза раствора хлорида калия (KCl).
В отличие от хлорида натрия, который содержится в залежах каменной соли содержанием выше 99%, содержание хлорида калия в калийных отложениях составляет всего 10-40%. Основными сопутствующими солями являются хлорид натрия и соли магния, которые должны быть отделены в процессе производства.
В результате хлорид калия имеет гораздо более высокую цену исходного сырья, чем хлорид натрия. Таким образом, гидроксид калия значительно дороже каустической соды и, производится в меньших объемах.
Гидроксид калия используется в качестве абсорбента и смягчающего воду компонента для жидких моющих средств.
Гидроксид кальция (гашеная известь)
Гидроксид кальция представляет собой белый аморфный коррозийный порошок, который плохо растворяется в воде (около 1,3 г / л при 20 C).
Известковая вода называется отфильтрованным водным раствором, который очень сильно реагирует с основаниями. Его можно использовать в качестве реагента для обнаружения углекислого газа, поскольку при прохождении воздуха, содержащего углекислый газ, трудно растворимый карбонат кальция осаждается в виде крошечных кристаллов.
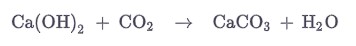
Гидроксид кальция получают реакцией оксида кальция (негашеной извести) с водой. Эта реакция называется гашением извести.
Диапазон применения гидроксида кальция чрезвычайно разнообразен. Еще древние римляне использовали суспензию гидроксида кальция в известковой воде (известковое молоко) для отбеливания стен.
Гидроксид кальция используется для десульфурации дымовых газов на электростанциях, в качестве связующего для водорастворимых красок, при производстве сахара из сахарной свеклы и в качестве добавки для минеральных удобрений.
Гидроксид бария
Гидроксид бария представляет собой белый, кристаллический, едкий и токсичный порошок. Гидроксид бария и его октагидрат являются чрезвычайно токсичными веществами. В отличие от гидроксидов кальция и стронция, оба соединения легко растворимы в воде.
Гидроксид бария получают взаимодействием оксида бария с водой с сильным выделением тепла.
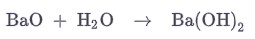
Баритовую воду называют сильно щелочным водным раствором гидроксида бария. Его можно использовать как известковую воду для обнаружения углекислого газа. Раствор является важным строительным материалом.
Кроме того, гидроксид бария используется при обработке воды, в керамике, в качестве добавки при производстве стабилизаторов ПВХ и специальных мыл.
Аммиак
Аммиак — бесцветный газ с характерным запахом и легко растворимый в воде.
Аммиак используется для производства других соединений азота, в том числе азотной кислоты. Также используется для производства удобрений, пластмасс, пестицидов, в качестве хладагента в контурах охлаждения холодильных установок.
ОСОБЕННОСТИ ХИМИКО-ТЕХНИЧЕСКИХ ПРОЦЕССОВ