Аммиак (NH3) представляет собой бесцветный, ядовитый газ. Химическое соединение азота и водорода. Плотность газообразного аммиака меньше плотности воздуха.
Аммиак очень хорошо растворяется в воде. Полученный раствор называется аммиачной водой или гидроксидом аммония, обладает очень резким, неприятным запахом.
Аммиак оказывает разъедающее действие на поверхность кожи и слизистых оболочек. При проглатывании вызывает кровавую рвоту, возможно со смертельным исходом.
Основные свойства
Аммиак является амфотерным соединением со способностью проявлять как кислотные, так и основные свойства.
В жидком аммиаке существует равновесие, которое может быть описано следующей формулой:
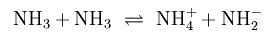
Структура молекулы аммиака
Молекула аммиака соответствует трехсторонней пирамиде (тригонально-пирамидальная). Состоит из тетраэдра, в которой свободная (не связанная) электронная пара азота занимает угол.
N-H-связывающие электроны и неподеленная пара максимально удалены друг от друга. Из-за более высокой электроотрицательности азота по сравнению с водородом существует более высокая плотность отрицательного заряда вблизи неподеленной пары электронов. Одинокая пара электронов может смещаться на противоположную сторону, что приводит к «колебанию» молекулы, которое можно сравнить со складыванием зонта.
Это также относится и к соединениям, полученным из аммиака (например, аминов), если только им не препятствует «раскачивание» из-за жесткой геометрии остальной части молекулы.
Обнаружение аммиака
Классические методы
- Достаточно осторожно понюхать предлагаемый образец.
- Небольшие количества газа могут быть обнаружены с помощью увлажненной индикаторной бумаги.
Фотометрические методы
- Аммиак реагирует с тетраиодомеркуратом с образованием оранжевого соединения (реакция Несслера).
- Аммиак образует хлорамин с гипохлорит-ионами (реакция Бертло).
Производство
Около 90% промышленного производства аммиака основано на связывании атмосферного азота с водородом (процесс Габера-Боша).
Альтернативными методами производства являются извлечение извести азота (процесс извлечения из азота) или путем гидролиза нитридов.
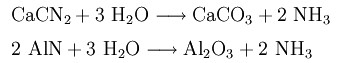
Оба метода не имеют существенного промышленного значения, поскольку синтез по методу Габера-Боша значительно дешевле.
Другим способом получения NH3 является восстановление оксида азота (NO) водородом (H2).
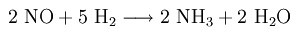
Применение
Аммиак является одним из наиболее важных и распространенных продуктов химической промышленности. Ежегодное мировое производство аммиака составляет около 125 миллионов тонн.
Около 3% мировой энергии используется для производства аммиака.
Большая часть продукции используется в качестве сырья для азотных удобрений и производства азотной кислоты.
Помимо этого, аммиак используется:
- в холодильных машинах из-за его высокой теплоты испарения;
- в текстильной промышленности;
- для пластификации древесины;
- в металлургии;
- аммиачная вода используется для очистки, травления и дезинфекции;
- аммиак также можно использовать для обессеривания дымовых газов. В результате образуется сульфат аммония, который используется в качестве удобрения;
- для изготовления лекарств и взрывчатых веществ.
Безводный аммиак
Безводный аммиак или просто аммиак — это чистый газ в виде сжатой жидкости, который не содержит воды. Он используется в производстве удобрений, взрывчатых веществ, чистящих средств, фармацевтических препаратов.
Производители продуктов питания и напитков используют тонны аммиака для охлаждения, быстрого замораживания и хранения готовых изделий.
Токсичный газ
При воздействии тепла раствор аммиака разлагается с образованием газообразного аммиака и оксида азота (NO).
При увеличении концентрации в воздухе, аммиак может вызывать следующие симптомы:
Содержание аммиака ppm (единица измерения концентрации – частей на миллион) в воздухе:
- 0 – 25: Раздражение глаз и дыхательных путей;
- 50 – 100: Отек век, конъюнктивит, рвота и сильное раздражение горла;
- 100 – 500: Концентрации, связанные с опасностью для здоровья.
Длительное воздействие высоких концентраций может привести к смерти.
Интересный факт
Аммиак вырабатывается бактерией Helicobacter pylori в желудке с помощью фермента уреазы из мочевины, содержащейся в желудке, чтобы нейтрализовать желудочную кислоту. Эта бактерия является наиболее распространенной причиной язвы желудка.







