Кислоты известны человеку уже очень давно. Хотя маловероятно, что в древности эти вещества расценивались как химические элементы, но их специфический вкус был хорошо понятен любому человеку.
Греки и римляне пользовались освежающим эффектом цитрусовых. Этот эффект обусловлен наличием в фруктах лимонной кислоты.
Поскольку в химической лаборатории нельзя пробовать языком вещества, не подвергая опасности свое здоровье, были разработаны специальные измерительные приборы и введен термин «кислота».
В 13-м веке азотная и серная кислоты были впервые упомянуты в письмах византийских ученых. Их добыча впервые описана в 1250 году алхимиком Гебером. Азотную кислоту он получал путем «дистилляции» из солей квасцов и купороса, а серную — добавляя селитру (нитрат калия) к смеси солей.
Во времена Ренессанса кислоты, которые называли «горячей водой», приобретают важное значение. Азотная кислота использовалась при обработке драгоценных металлов. Например, в Венеции в 15 веке она использовался для отделения серебра от золота.
Соляная кислота впервые была получена в 16 веке.
Экономическое использование серной кислоты началось только в середине 18 века. Основными областями ее применения были крашение и отбеливание тканей.
Английский исследователь РОБЕРТ БОЙЛ (1627-1691) первым выделил кислоты и основания. Он обнаружил, что кислоты окрашивают растительный краситель лакмусовый в красный цвет и растворяют мрамор. Основания окрашивают лакмусовый в синий и образуют соли при смешивании с кислыми растворами.
Теория Аррениуса
Первую научную кислотную теорию разработал шведский химик Сванте Аррениус (теория электролитической диссоциации). В своем определении 1887 года под кислотой он понимал вещество, которое имеет кислый вкус и в водном растворе содержит ионы водорода.
Следовательно, в воде кислота диссоциирует на ионы водорода и ионы кислотных остатков в соответствии со следующим общим уравнением:
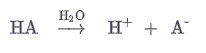
По мнению Аррениуса кислоты, представляют собой ион кислотного остатка, полученный в результате диссоциации.
Для азотной кислоты уравнение имеет вид:
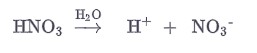
Азотная кислота диссоциирует в воде на ионы водорода, и нитрат-ионы кислотных остатков.
Согласно Аррениуса, основания — это вещества, которые имеют мыльный вкус и образует в воде гидроксид-ионы.
В целом, для гидроксидов металлов верно:
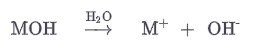
Пример гидроксида натрия:
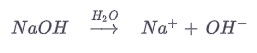
Но это определение пришлось расширить, потому что оно имело большой недостаток. В своем определении Аррениус ограничился только водными растворами. С его позиции, для появления кислоты или основания всегда нужна вода. Однако позже стали также известны кислотно-основные реакции, которые не происходили в водных растворах.
Кроме того, было признано, что некоторые основания, такие как аммиак, не обязательно содержат гидроксид-ионы и, что свободные протоны (ионы водорода) не могут существовать в водном растворе.
Теория Бренстеда-Лаури
Независимо друг от друга датский химик Бренстед и англичанин Лаури разработали новое определение концепции кислотно-основного состояния в 1923 году.
Согласно Бренстеду, кислота — это вещество или соединение, способное стать донором протонов, а основания наоборот забрать их. Теория получила название протолитической теории кислот и оснований.
Обычно кислота реагирует с водой в соответствии с уравнением:

Для примера азотной кислоты это приводит к:

Основание, с другой стороны, представляет собой соединение, которое может поглощать протоны. Поэтому такое вещество также называют акцептором протонов.
Согласно этому определению ион кислотного остатка также рассматривается как основание:

Например, аммиак реагирует как основание в водной и неводной системах, хотя он не содержит гидроксид-ионов:

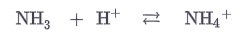
Основным требованием теории Бренстеда-Лоури является наличие частицы, которая возобновляет высвобождение протона, поскольку свободные протоны не являются стабильными.
Согласно Бренстеду, кислотно-основные реакции являются реакциями с протонным переходом.
Обычным акцептором протонов является молекула воды. Однако, эта теория не смогла объяснить кислотно-основные реакции, которые происходят в неводных системах, например, с аммиаком в качестве растворителя.
Электронная теория Льюиса
Американский химик Гилберт Н. Льюис разработал еще одну кислотно-щелочную концепцию. Он расширил понятие кислоты на все вещества, которые могут занимать свободную электронную пару (акцепторы электронных пар).
Таким образом, Льюис включает соединения с кислотами, которые сами по себе не содержат протонов, такие как катионы металлов или соединения.
Однако, согласно Льюису, основания — это вещества, которые имеют неподеленную пару электронов и могут высвобождать их или делать их доступными для образования связи. Их также называют донорами электронных пар. К ним относятся вода и все анионы.
Одним из наиболее известных примеров основания является аммиак. Атом азота в аммиаке имеет три связи с атомами водорода, а также два свободных внешних электрона в виде неподеленной пары электронов.
Теория Льюиса является продолжением теории Бренстеда-Лоури. Так, например, ход нуклеофильного замещения на ароматических соединениях хлоридом алюминия в качестве катализатора может быть хорошо проиллюстрирован с помощью теории Льюиса.
Однако, согласно Льюису, сила кислот и оснований не может быть описана количественно. Кроме того, такие соединения, как вода или хлористый водород, больше не считаются кислотами. Поэтому наиболее наглядной моделью кислот и оснований для многих научных процессов все еще остается теория Бренстеда-Лоури.
ОСОБЕННОСТИ ХИМИКО-ТЕХНИЧЕСКИХ ПРОЦЕССОВ
Диссоциация и электролиз. Окислительно-восстановительная реакция