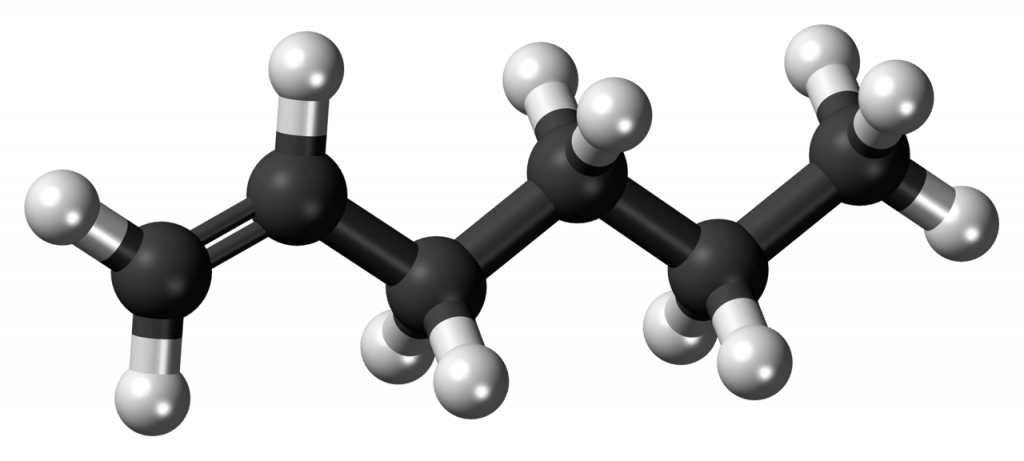
В органической химии алканы (ранее парафины) представляют собой группу простых насыщенных углеводородов, в которых нет кратных связей между атомами. Как и все углеводороды, они состоят только из двух элементов: углерода (C) и водорода (H) и относятся к насыщенным соединениям.
Основная структура алканов может состоять из разветвленных и неразветвленных цепей, а также колец. Первые два типа, которые называются н-алканами и изо- или неоалканами, образуют гомологический ряд с общей эмпирической формулой CnH2n + 2. Кольцеобразные молекулы называются циклоалканами, они имеют некоторые отличия от цепочечных алканов как по структуре, так и по физическим и химическим свойствам.
Алканы представляют собой однородную группу веществ, образующих основу для многих других групп органических веществ. Однако из-за различной молекулярной топологии циклоалканы обладают свойствами, которые в некоторых случаях значительно отличаются от свойств цепных алканов.
Номенклатура
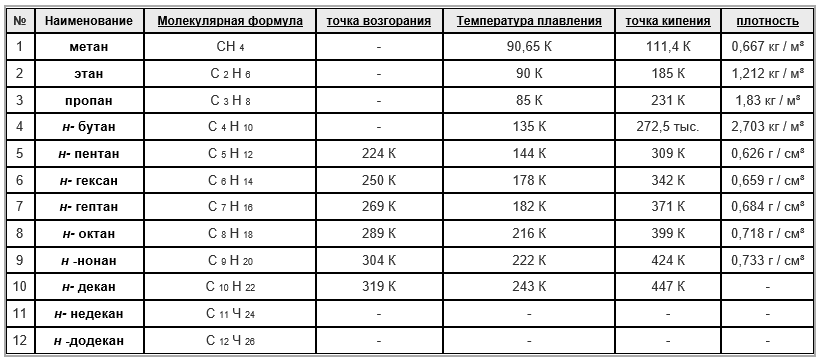
Номенклатура алканов определена Международным союзом теоретической и прикладной химии (IUPAC). Все имена имеют окончание -ан. Этому окончанию предшествует греческое число, обозначающее количество атомов углерода. Для первых четырех алканов это тривиальные названия, названия метан, этан, пропан и бутан даны по историческим причинам.
К разветвленным алканам применяются следующие правила наименования:
- Атомы углерода самой длинной непрерывной углеродной цепи пронумерованы последовательно, так что третичные или четвертичные атомы углерода имеют наименьшее возможное число. Молекула носит название по этой цепочке.
- Номера атомов углерода, у которых разветвляются алкильные группы, разделяются запятыми и помещаются перед названием алкана.
- Число разветвленных алкильных групп записывается в их греческой нотации (ди = два, три = три и т.д.) в виде числа после дефиса.
- Название разветвленной алкильной группы пишется строчными буквами. Если есть несколько разветвленных алкильных групп, ставится дефис, а остальные разветвления обрабатываются согласно шагам 1, 2 и 3.
- Специальное окончание -aн добавляется в конце.
В прошлом алканы назывались парафинами и маргинальными углеводородами. Название произошло от латинского “para affinis”, что переводится как «небольшой наклон», и выражало относительную инерцию этих соединений. Сегодня это название обычно относится только к смеси определенных твердых алканов.
Алкильный радикал
Если из молекулы алкана удалить атом водорода, образуется радикал, молекула с несвязанным электроном, известный как алкил. Название этого алкильного радикала получено путем замены -aн на -ил на конце алкана. Символично, что алкилы часто обозначаются R. Если алкильные радикалы разные, это обозначается R1, R 2, R3 и т. д. Алканы можно трактовать как димеризованные алкилы.
Молекулярная геометрия
Пространственная структура алканов напрямую влияет на их физические и химические свойства. Электронная конфигурация углерода имеет решающее значение для их понимания. В основном состоянии его атомы имеют четыре свободных электрона, так называемые валентные электроны, которые доступны для связей и реакций. В несвязанном атоме углерода эти четыре электрона находятся на орбиталях с разной энергией, однако в алканах атом углерода всегда гибридизован, что означает, что при наложении четырех начальных орбиталей (одна s-орбиталь и три p-орбитали) получается четыре новые орбитали. Они пространственно имеют форму тетраэдра. Таким образом, угол между ними составляет 109,47 градуса.
Конформация алканов
Как правило, знание структурной формулы и валентного угла не полностью определяет пространственную структуру молекулы. Для каждой связи углерод-углерод существует дополнительная степень свободы: угол, который три атома или группы атомов, связанных с двумя связующими атомами, образуют по отношению друг к другу. Пространственное расположение, описываемое этими углами, называется конформацией.
Циклоалканы
Циклоалканы — это особая форма алканов, в которых углеродные связи образуют одно или несколько замкнутых колец: если кольцо только одно, говорят о моноциклических, в противном случае — о полициклических циклоалканах. Они не вписываются в гомологический ряд цепных алканов с общей эмпирической формулой CnH2n + 2, но каждое кольцо уменьшает количество атомов водорода на два. В моноциклическом случае общая эмпирическая формула соответствует CnH2n.
Подобно цепочечным алканам, циклоалканы состоят только из связей CH и CC. Кольцевая структура влияет на реакционную способность и физические свойства, такие как точки плавления и кипения. Она также предотвращает вращение вокруг связей между атомами углерода, которое приводит к цис-транс-изомерии циклопентана.
Н-алканы
Самый простой алкан — метан. Он также является основным строительным блоком для всех высших алканов.
Изо и нео алканы
По мере увеличения количества атомов углерода увеличивается и количество возможностей их ковалентной связи. Вот почему все алканы имеют большее количество атомов углерода, чем пропан, во множестве изомеров — молекул с одной и той же эмпирической формулой, но разной структурой (составом). Эта связь называется конституциональной изомерией.
В случае бутана при одной и той же эмпирической формуле C4H10 возможны два различных расположения атомов углерода в молекуле алкана. Бутан существует в двух различных конституций: н-бутана и изо-бутана.
Пентан уже существует в трех различных формах: н-алкан с неразветвленной цепью, изопентан с одной ветвью на втором атоме углерода и неопентан с двумя разветвлениями на втором атоме углерода. Как правило, разветвленные алканы с метильной группой в положении 2 от конца цепи называются изоалканами, а алканы с двумя метильными группами в этой точке — неоалканами.
По мере увеличения числа атомов углерода увеличивается и количество возможных изомеров, большинство из которых, однако, существует только теоретически — лишь некоторые из них важны для природы и техники.
Этан
Самый элементарный в классе алканов — этан. Если посмотреть на молекулу вдоль определенной оси, вы увидите то, что известно как проекция Ньюмана: один атом углерода в проекции с тремя атомами водорода на переднем плане, другой находится на заднем плане. Связи с тремя атомами водорода можно увидеть на диаграмме только частично. И передние, и задние три атома водорода расположены под углом 120 градусов друг к другу в проекции, что также должно относиться к проекции тетраэдра на плоскость. Однако угол между двумя группами атомов водорода не фиксирован — он описывает конформацию в молекуле этана.
Угол конформации может принимать любое значение от 0 до 360 градусов, но качественно интерес представляют только две различные конформации:
- В эклиптической конформации угол конформации составляет 0, 120 или 240 градусов, в проекции совпадают один передний и один задний атом водорода.
- В шахматной конформации угол конформации составляет 60, 180 или 300 градусов, так что в проекции задний атом водорода оказывается между двумя передними.
Две конформации, также называемые ротамерами, различаются по своей энергии, которая в данном случае является энергией кручения: примерно 12,6 килоджоулей на моль. Хотя эклиптическая конформация максимизирует ее и поэтому нестабильна, она минимизируется ступенчатой конформацией, которая, следовательно, является энергетически предпочтительной.
Все другие конформации находятся между этими двумя крайностями с точки зрения их энергии. Причина различия еще не полностью выяснена: в эклиптической конформации расстояние между электронами связи CH переднего и заднего атомов углерода меньше, электростатическое отталкивание между ними и, следовательно, энергия состояния выше. И наоборот, шахматная конформация позволяет более сильную делокализацию связывающих электронов. Явление, которое стабилизирует структуру и снижает энергию. Сегодня более вероятным считается последнее объяснение.
Высшие алканы
В то время как качественно то же самое относится к двум связям CC в молекуле пропана, что и к этану, ситуация для бутана и всех высших алканов более сложна.
Если посмотреть на среднюю СС-связь молекулы бутана, каждый из двух атомов углерода связан с двумя атомами водорода и одной метильной группой. Как видно из проекции Ньюмана, можно выделить четыре качественно различных ротамера, между которыми возможны любые переходные состояния. Как и в случае с этаном, они соответствуют конформации максимальной или минимальной энергии.
Если две метильные группы находятся в одном и том же месте в проекции, то есть под углом кручения 0 градусов, говорят о полностью эклиптической или синперипланарной конформации. Это соответствует глобальному максимуму торсионной энергии, поскольку атомы водорода метильных групп подходят настолько близко, что между их электронными облаками возникает отталкивание.
При угле кручения 60 или 300 градусов строение называется косым или синклинарным. В отличие от эклиптических структур, все атомы или группы атомов переднего атома углерода располагаются между атомами заднего атома углерода в проекции. Если угол кручения составляет 120 или 240 градусов, то конформация частично эклиптическая.
Наконец, при угле кручения 180 градусов наблюдается антиперипланарная конформация. Как и в случае с шахматной конформацией этана, здесь происходит повышенная делокализация электронов, которую можно объяснить только квантовой механикой, в то время как в то же время две метильные группы занимают максимально возможное пространственное расстояние друг от друга. Таким образом, торсионная энергия для этого состояния минимизирована в целом.
Энергетическая щель между син- и антиперипланарной конформациями составляет около 19 килоджоулей на моль и, следовательно, все еще мала по сравнению с тепловой энергией при комнатной температуре. Следовательно, вращение вокруг центральной оси CC по-прежнему возможно. Однако, как и в случае с этаном, вероятность обнаружения молекулы в определенном состоянии не такая же: для антиперипланарной конформации она примерно вдвое выше, чем для синклинальной конформации, в то время как для двух эклиптических конформаций она пренебрежимо мала.
С высшими алканами картина в основном такая же — для всех связей CC антиперипланарная конформация, в которой присоединенные алкильные группы находятся на максимально возможном расстоянии, является наиболее энергетически выгодной и, следовательно, наиболее вероятной. По этой причине структура алканов обычно представлена зигзагообразным расположением. Фактическая структура всегда будет несколько отличаться от этой идеализированной конформации при комнатной температуре — поэтому молекулы алканов не имеют фиксированной формы стержня, как может предполагать модель.
Другие углеводородные молекулы, такие как алкены, основаны на этой базовой структуре, но также содержат участки повышенной жесткости из-за двойных связей, которые могут привести к постоянному «изгибу».
Свойства
Алканы образуют однородный класс веществ, и знания свойств некоторых представителей достаточно, чтобы предсказать поведение других. Это относится как к внутри- и межмолекулярным взаимодействиям алканов, которые влияют на температуры плавления и кипения, так и к рассмотрению их синтезов и реакций.
Для циклоалканов существует ряд особенностей, которые возникают, среди прочего, из-за кольцевой деформации, имеющей место в большинстве молекул (за важным исключением циклогексана), которая оказывает длительное влияние на реакционную способность.
Физические свойства
Молекулярная структура, особенно размер поверхности молекул, определяет точку кипения связанного вещества: чем меньше площадь, тем ниже точка кипения, поскольку силы Ван-дер-Ваальса, действующие между молекулами, меньше. Уменьшение поверхности может быть достигнуто за счет разветвления или кольцевой структуры. На практике это означает, что алканы с более высоким содержанием углерода обычно имеют более высокую температуру кипения, чем алканы с более низким содержанием углерода. Разветвленные алканы имеют более низкую температуру кипения, чем неразветвленные. Из пяти атомов углерода неразветвленные алканы при нормальных условиях являются жидкими, из семнадцати — твердыми.
За одним исключением в случае пропана, температура плавления алканов также увеличивается с увеличением числа атомов углерода. Однако в случае высших алканов, точки плавления повышаются медленнее, чем точки кипения. Кроме того, температура плавления алканов с нечетным числом атомов углерода до алканов с четным числом атомов углерода увеличивается больше. Причина этого явления — большая плотность упаковки алканов с четным числом атомов углерода. Температура плавления разветвленных алканов может быть выше или ниже соответствующего значения для неразветвленных алканов. Чем крупнее молекула, тем труднее плотно упаковать соответствующее вещество и тем ниже температура плавления. Напротив, существует ряд изоалканов. которые имеют гораздо более компактную структуру, чем соответствующие н-алканы.
Алканы не проводят электричество. По этой причине они не образуют водородных связей и очень трудно растворяются в полярных растворителях, таких как вода. Поскольку водородные связи между отдельными молекулами воды в непосредственной близости от точки алкана от нее и, следовательно, не изотропно выровнены, то есть не указывают равномерно во всех направлениях, смесь обоих веществ приведет к увеличению молекулярного порядка. Так как это запрещено вторым законом термодинамики, при попытке смешивания всегда образуются два отдельных слоя. Поэтому алканы называют водоотталкивающими или гидрофобными. С другой стороны, их растворимость в неполярных растворителях хорошая (липофильность). Например, они могут быть смешаны друг с другом в любом соотношении при одинаковом физическом состоянии.
Химические свойства
В общем, алканы показывают низкую реакционную способность, потому что их связи CH и CC относительно стабильны и их нелегко разорвать. В отличие от всех других органических соединений они не имеют функциональных групп. Они очень плохо реагируют с ионными или более полярными веществами.
Однако алканы вступают в окислительно-восстановительные реакции, в частности, с кислородом и галогенами, поскольку их атомы углерода находятся в сильно восстановленном состоянии. В случае метана достигается даже минимально возможный уровень окисления -IV.
Радикалы, то есть молекулы с неспаренными электронами, играют важную роль в большинстве реакций, включая так называемые крекинг и риформинг, в которых длинноцепочечные алканы превращаются в короткоцепочечные, а неразветвленные — в разветвленные.
В случае сильно разветвленных молекул валентный угол должен отклоняться от оптимального значения, что вызвано тем фактом, что в противном случае алкильные группы на разных атомах углерода сблизились бы. Результирующее «напряжение», известное как стерическое натяжение, делает эти молекулы гораздо более реактивными.
Реакции
Реакции с кислородом
Все алканы реагируют с кислородом, но не способствуют возгоранию. Однако их температура вспышки повышается с увеличением числа атомов углерода. По сравнению с другими углеводородами, такими как алкены и алкины, они реагируют с выделением большей части энергии. Двойная или тройная связь высвобождает больше энергии, чем одинарная, но это компенсируется большим количеством окисляемых атомов водорода в молекуле (6 для этана, 4 для этена и 2 для этина). Стандартные энтальпии сгорания при следующих значениях:
- Этан: -372,80 ккал / моль;
- Этен: -337,22 ккал / моль;
- Этин: -310,60 ккал / моль.
Таким образом, большая часть энергии выделяется при сжигании этана (отрицательная энтальпия). При достаточном поступлении кислорода алканы горят слабым светящимся пламенем без сажи.
Химически реакция с кислородом представляет собой окислительно-восстановительную реакцию, в которой алканы окисляются, а кислород восстанавливается. При полном сгорании углерод реагирует на двуокись углерода (степень окисления + IV), а водород — на воду, которая выделяется в виде водяного пара. Н-алкан реагирует с кислородом с образованием воды и диоксида углерода.
Общая энергия горения увеличивается с увеличением числа атомов углерода: каждая группа CH дает около 650 килоджоулей на моль. Если алканы не полностью сгорают из-за недостатка кислорода, образуются нежелательные побочные продукты, такие как алкены, углерод и монооксид углерода.
Октан реагирует с кислородом с образованием диоксида углерода, оксида углерода, углерода (сажи), пропена и воды. Таким образом, черный дым указывает на недостаточное поступление кислорода при сжигании бензина.
Реакции с галогенами
Другой важной реакционной группой алканов являются реакции галогенирования — они также принадлежат к большей группе окислительно-восстановительных реакций, поскольку степени окисления соответствующих атомов углерода меняются.
При галогенировании атомы водорода алкана частично или полностью заменяются или замещаются атомами галогена, такими как фтор, хлор или бром, поэтому говорят о реакции замещения. Метан реагирует с хлором с образованием моно-, ди-, три- и тетрахлорметана, а также хлористого водорода.
Соотношение в смеси отдельных галогеналканов зависит от условий реакции и выбирается в уравнении реакции совершенно произвольно, т.е. не является репрезентативным.
Реакция с хлором запускается даже при низком потреблении энергии в виде ультрафиолетового света — высокий выход реакции на единицу энергии указывает на то, что это цепная реакция. В этом случае, если присутствует галогеновый радикал, по мере протекания реакции постоянно воспроизводится новый, по крайней мере, до тех пор, пока не будет разрушен избыток атомов галогена.
Как и в любой цепной реакции, в реакциях галогенирования участвуют три стадии:
Инициирование: двухатомные молекулы галогена гомолитически расщепляются, например, посредством облучения светом высокой энергии, то есть при симметричном разделении электронов, на радикалы:
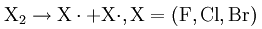
Этап 2: радикал галогена высвобождает атом водорода из молекулы алкана и оставляет после себя алкильный радикал:
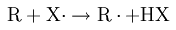
Этап 3: Алкильный радикал отделяет атом галогена от молекулы галогена и оставляет после себя радикал галогена:
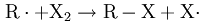
Шаг 1 и шаг 2 непрерывно чередуются во время реакции — все большее количество продуктов реакции создается из нескольких исходных радикалов хлора.
Прекращение: реакция останавливается, когда вероятность встречи двух радикалов больше, чем вероятность встречи с исходным продуктом (или алканом, который еще не полностью галогенирован). В этом случае происходит рекомбинация:
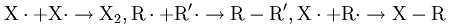
Хотя последняя из этих реакций обрыва также приводит к галогеналканам, количество продуктов, полученных таким образом, незначительно по сравнению с количеством продуктов, полученных в цепной реакции.
В приведенном выше примере не было сделано никаких заявлений о том, какие атомы водорода заменяются первыми в случае данного алкана. Этот вопрос не возникает для наиболее важных случаев метана или этана, поскольку все атомы водорода эквивалентны. Однако, начиная с пропана, некоторые из них связаны со вторичными или третичными атомами углерода, то есть с двумя или тремя связями с другими атомами углерода. Эти связи более слабые, что в случае галогенирования приводит к тому, что атомы водорода, расположенные на вторичном или даже третичном углероде, предпочтительно заменяются галогенами.
Хлорированные и фторированные метановые газы имеют особое техническое значение, но реакция на них может привести к взрыву. Трихлорметан ранее использовался в качестве анестетика под названием хлороформ, фтор-хлорные углеводороды долгое время служили топливом, пока они не утратили свое значение из-за их вредного воздействия на озоновый слой Земли.
Крекинг и риформирование
Важными реакциями при переработке сырой нефти являются крекинг и риформинг. В первом случае низшие алканы получают из высших алканов при высоком давлении и высокой температуре. Связи C расщепляются на катализаторах, таких как оксид алюминия:
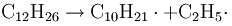
Додекан распадается на децильный и этильный радикалы. Они рекомбинируют с образованием новых алканов. Пример:
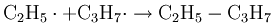
Этиловый и пропильный радикалы реагируют с образованием пентана.
Подходящие условия реакции могут быть использованы для обеспечения образования в основном коротких молекул алкана в результате этих реакций. Таким же образом можно в значительной степени предотвратить деструктивные побочные реакции, такие как образование алкенов. Обычно во время крекинга добавляют водород для удаления примесей, таких как сера или азот — это называется гидрокрекингом.
Напротив, риформинг необходим в случае смесей алканов, которые должны использоваться в качестве бензина. Для этого неразветвленные алканы, которые обладают неблагоприятными для этого свойствами для горения, превращаются на катализаторах в разветвленные алканы, то есть ароматические углеводороды.
Техника безопасности
Метан может взорваться при объемной доле воздуха от одного до восьми процентов без источника воспламенения и является сильным парниковым газом, а некоторые другие смеси низших алканов и воздуха самовоспламеняются от определенной фракции алкана. Алканы могут представлять опасность из-за их воспламеняемости. Однако с увеличением содержания углерода возрастает и температура вспышки. Пропан, бутан, пентан, гексан, гептан, октан и некоторые другие алканы являются опасными веществами.
Нахождение
Алканы встречаются как на Земле, так и в Солнечной системе, но большинство из них только в следовых количествах. Большое значение для небесных тел имеют в первую очередь легкие углеводороды: два газа — метан и этан — были обнаружены как в хвосте кометы Хиякутаке, так и в некоторых метеоритах. Они также составляют важную часть атмосфер внешних газовых планет Юпитера, Сатурна, Урана. На Марсе в атмосфере были обнаружены следы метана, что на сегодняшний день является самым убедительным свидетельством существования живых существ (почвенных бактерий) на этой планете.
На Земле метан присутствует в следовых количествах в атмосфере, его содержание составляет около 0,0001 процента или 1 ppm («частей на миллион»), и он в основном производится бактериями. Содержание в океанах незначительно из-за отсутствия растворимости в воде, но метан находится под высоким давлением и при низкой температуре в водяном льду, замороженном на дне океанов в виде так называемого гидрата метана. Хотя его коммерческая добыча и по сей день невозможна, теплотворная способность известных месторождений гидрата метана во много раз превышает содержание энергии всех месторождений природного газа и сырой нефти вместе взятых — поэтому метан, полученный из гидрата метана, является кандидатом на “топливо будущего”.
Однако сегодня наиболее важными коммерческими источниками алканов являются природный газ и нефть, которые являются единственными органическими соединениями, встречающимися в природе в минеральной форме. Природный газ в основном содержит метан и этан, а также пропан и бутан, а сырая нефть состоит из смеси жидких алканов и других углеводородов. И то, и другое возникло, когда мертвые морские животные в отсутствие кислорода и преобразовались в течение многих миллионов лет при высоких температурах и высоком давлении.
Твердые алканы образуются в виде остатков после испарения нефти, известных как земной воск. Одно из крупнейших месторождений природных твердых алканов находится в так называемом асфальтовом озере Ла-Бреа на карибском острове Тринидад.
Применение и дальнейшая обработка
С одной стороны, алканы являются важным сырьем в химической промышленности, где они перерабатываются, например, в пластмассы, а с другой стороны, они являются наиболее важным топливом в мировой экономике.
Отправной точкой для переработки всегда является природный газ и сырая нефть. Последняя отделяется на нефтеперерабатывающем заводе фракционной перегонкой, а затем перерабатывается во многие другие важные продукты, например, бензин. При этом используется то преимущество, что разные «фракции» сырой нефти имеют разные точки кипения и, таким образом, могут быть легко отделены друг от друга.
Соответствующую область применения определенного алкана можно довольно хорошо разделить по количеству содержащихся в нем атомов углерода, хотя следующее разграничение является идеальным и не применяется строго:
- Первые четыре алкана в основном используются для отопления и приготовления пищи. Метан и этан — основные компоненты природного газа, они обычно хранятся под давлением в газообразном состоянии. Однако их транспортировка в жидком состоянии дешевле, поэтому для этого необходимо сжимать газ под высоким давлением.
- Пропан и бутан, напротив, могут быть сжижены, имеют низкое давление и, следовательно, поступают в жидком виде перед использованием в качестве топлива — в качестве сжиженного нефтяного газа в двигателях внутреннего сгорания. Пропан используется, например, в газовых горелках на пропане, бутан в зажигалках — когда он выходит, жидкость, состоящая из 95 процентов н-бутана и 5 процентов изобутана, превращается в смесь газа и мелких капель и легко воспламеняется.
- Пентан-октан — это легколетучие жидкости, поэтому их можно использовать в качестве топлива в обычных двигателях внутреннего сгорания, поскольку они легко переходят в газообразное состояние, когда попадают в камеру сгорания, и не образуют там капель, которые могут ухудшить равномерность сгорания. В топливе желательны только разветвленные алканы, поскольку они не склонны к преждевременному воспламенению, как неразветвленные. Показателем преждевременного воспламенения бензина является его октановое число. Он указывает на степень склонности вещества к самовозгоранию. Два алкана: гептан (н-гептан) и изооктан (2,2,4-триметилпентан) были произвольно выбраны в качестве ссылочных чисел для значений октана, каждый из которых имеет октановое число 0 (гептан имеет тенденцию к преждевременному воспламенению) и октановое число 100 (изооктан, почти не склонен к самовозгоранию). Октановое число топлива показывает, какому соотношению изооктана и гептана соответствуют его детонационные свойства. Средние алканы не только служат топливом, но и являются хорошими растворителями для неполярных веществ.
- Алканы, начиная с гексадекана и выше, являются наиболее важными составляющими печного топлива и смазочного масла. В последней функции, они также действуют как антикоррозионные агенты. Многие твердые алканы используются в качестве парафинового воска, из которого, например, можно делать свечи. Однако не следует путать его с настоящим воском, который состоит в основном из сложных эфиров.
- Алканы с длиной цепи около 35 или более атомов углерода содержатся в асфальте, поэтому они используются, среди прочего, в качестве дорожных покрытий. В целом, однако, высшие алканы не имеют большого значения и поэтому в основном распадаются на низшие алканы путем крекинга.
Алканы в живой природе
Алканы встречаются в природе по-разному, но они не являются биологически важными веществами. Циклоалканы с содержанием углерода от 14 до 18 встречаются, например, в ароматизаторах, таких как мускус.
Бактерии
Определенные типы бактерий превращают алканы в процессе метаболизма. Метанообразователи также являются производителями болотного газа, выделяемого в болотах, который аналогичным образом производится в коллекторных башнях очистных сооружений и ежегодно выделяет около двух миллиардов тонн метана. За содержание этого газа в атмосфере ответственный почти исключительно они.
Грибы и растения
В трех основных эукариотических группах живых существ, грибов, растений и животных алканы также играют определенную роль, хотя и незначительную. В первом случае более летучие представители появляются в основном в спорах: некоторые специализированные дрожжи, используют алканы в качестве источника энергии и углерода. Керосиновый гриб (Amorphotheca resinae ) преимущественно метаболизирует авиационное топливо из длинноцепочечных н-алканов.
Длинноцепочечные твердые представители в основном встречаются в растениях. Почти во всех из них они образуют твердый слой воска, который покрывает внешнюю кожу. Их функция, с одной стороны, заключается в защите от обезвоживания, с другой — в предотвращении вымывания важных минералов дождем и, наконец, в защите от бактерий, грибков и насекомых-вредителей. Блестящий слой на фруктах, таких как яблоки, также состоит из длинноцепочечных алканов.
Углеродные цепи обычно имеют длину от двадцати до сорока атомов и создаются растениями из алкановых кислот. Состав воскового слоя зависит не только от вида растения, он также меняется в зависимости от сезона, а также от факторов окружающей среды, таких как условия освещения, температура или влажность.
Животные
У животных алканы присутствуют в масляных тканях, но, в отличие от непредельных углеводородов, они не играют значительной роли. Примером является печень акулы, которую можно получить из масла, которое составляет около 14 процентов пристана, алкана, имеющего структурное название 2,6,10,14-тетраметилпентадекан (C19H40). Более важным является их присутствие в феромонах, химических веществах-посредниках.