Хлор является элементом основной группы VII и получил свое название от цвета газообразного хлора “хлорос” (зеленый). Это зелено-желтый, очень ядовитый газ с резким запахом. Хлор плохо растворяется в воде, 0,5% раствор называется хлорированной водой. Хлор тяжелее воздуха (примерно в 2,5 раза).
Хлор является очень реактивным газом и образует большое количество органических и неорганических соединений. Наиболее важными неорганическими соединениями являются хлористый водород, соляная кислота и встречающиеся в природе хлориды металлов, которые служат сырьем для производства многих химикатов и продуктов, например, каустическая сода, ПВХ, силиконов, моющих средств, пестицидов и средств от сорняков (гербицидов).
История
Хлор был открыт Карлом Вильгельмом Шееле в 1774 году.
Во время Первой мировой войны газообразный хлор использовали в качестве химического оружия. 22 апреля 1915 года недалеко от города Ипр во Фландрии германскими войсками был распылен газообразный хлор, что привело к гибели большого числа солдат и многочисленным жертвам, некоторые из которых остались инвалидами на всю жизнь. Однако, вскоре хлор заменили на более эффективные ядовитые газы, например, фосген.
Свойства
Желто-зеленый, негорючий, едкий газ, в 2,5 раза тяжелее воздуха. Хлор очень реактивен и вытесняет бром и йод из их водородных и металлических связей. Вступает в реакцию со многими другими элементами с образованием хлоридов. Умеренно растворим в воде, используется для хлорирования воды.
Смеси хлора и водорода (газообразный хлор-кислород) взрываются при воздействии тепла или света.
Нахождение в природе
Хлор не существует в природе в элементарной форме, но главным образом как анион Cl — (хлорид), который является очень реакционноспособным элементом. Но есть и природные органические соединения хлора (соли) с ковалентной связью. Например, хлорид натрия и хлорид калия можно найти во многих крупных солевых отложения. Хлориды составляют примерно 0,05% объема земной коры.
Производство
В промышленном масштабе, хлор получают с помощью так называемого хлорно-щелочного электролиза в виде хлорида натрия — раствора или расплава:
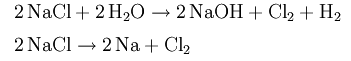
Соляная кислота, которая образуется в ходе реакции хлора с органическими углеводородами, также может быть использована в качестве исходного сырья. Которая может быть преобразована обратно в хлор с помощью электрического тока в водном растворе:
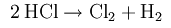
До появления электролитического процесса применялось прямое окисление хлористого водорода с кислородом или воздухом:
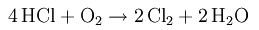
Эту равновесную реакцию проводили на катализаторах на основе хлорида меди (II) (CuCl2). Из-за крайне агрессивной реакционной смеси, этот технологический процесс был связан с большими трудностями.
В лабораторных условиях хлор можно получить реакцией перманганата калия с концентрированной соляной кислотой
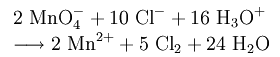
Реакцией диоксида марганца с концентрированной соляной кислотой
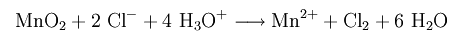
Реакцией хлорной извести с концентрированной соляной кислотой
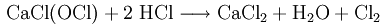
Физические свойства
При нормальных условиях хлор является газообразным веществом. Обладает едким, резким запахом и классифицируется как токсичный. Хлор относительно растворим в воде: 0,0921 моль растворяется в одном литре при 25 С при нормальном атмосферном давлении.
Этот водный раствор хлора называют хлористый водород и содержит небольшие количества соляной кислоты.
Химические свойства
Хлор не горит в воздухе, но он является одним из наиболее реактивных элементов в периодической таблице. Даже при нормальной температуре он реагирует с многочисленными элементами, многими органическими и неорганическими соединениями.
Реакции хлора
Наряду с фтором хлор является одним из самых реактивных элементов. Это мощный окислитель. Даже при комнатной температуре хлор реагирует со многими элементами, выделяя большое количество тепла (экзотермические реакции). С щелочными, щелочноземельными и другими металлами образует ионные соединения, соли металлов.
Неметаллы, такие как водород и фосфор, полуметаллы, такие как бор и кремний, реагируют с хлором с образованием молекулярных соединений. Поскольку хлор является очень реактивным элементом, он часто встречается в природе. Огромные солевые месторождения в основном содержат минералы каменную соль (NaCl), сильвин (KCl) или сильвинит. Количество хлоридов, растворенных в Мировом океане, почти неизмеримо, если учесть, что морская вода состоит в основном из хлоридных солей.
Изотопы
Природный хлор представляет собой смесь двух стабильных изотопов: 35 Cl и 37 Cl.
В атмосфере также наблюдается взаимодействие между изотопом хлора и протонами космического излучения с образованием нестабильного изотопа 36 Cl. Большие количества этого изотопа были получены при облучении воздуха во время испытаний ядерного оружия в атмосфере между 1952 и 1958 годами.
Соединения хлора
Хлор встречается с числами окисления от -1 до +7. В степени окисления -1 хлор присутствует в виде хлорид-аниона во многих солях, особенно в щелочных металлах: хлорид натрия, хлорид калия и хлорид лития. Однако, наиболее важным соединением Cl (-1) является хлористый водород (HCl) и его водный раствор, а также соляная кислота. Соединения с уровнями окисления +1, +3, +5, +7 существуют в основном в виде хлорангидридов кислот. С уровнем окисления +1 они представляют собой хлористоводородную кислоту (HClO) с ее солями, такими как гипохлорит натрия.
Хлороводород
Важными неорганическими соединениями хлора являются хлористый водород и хлориды. Хлороводород состоит из одного атома хлора и одного атома водорода, которые связаны полярной атомной связью. Бесцветен, имеет резкий запах, негорюч и хорошо растворяется в воде.
Газообразный хлористый водород менее реактивен, чем его водный раствор соляной кислоты.
Соляная кислота
Соляная кислота является сильной кислотой, потому что молекула HCl полностью диссоциирует на ионы водорода и ионы хлора в водном растворе. Соляная кислота реагирует с основными металлами в окислительно-восстановительной реакции с образованием водорода и хлоридов металлов. Она легко растворяет ряд оксидов и карбонатов металлов и поэтому может использоваться для очистки металлов (травление) и удаления накипи.
Обычными коммерческими формами являются разбавленная соляная кислота (около 7%), концентрированная соляная кислота (около 30%) и дымящая соляная кислота (около 37%). Как сильная неорганическая кислота, соляная кислота используется во многих отраслях промышленности. Помимо обработки металлов, она служит сырьем для производства различных соединений хлора, нейтрализации щелочных сточных вод и для кислотной обработки источников нефти и газа.
Хлориды
Хлориды — это соединения соляной кислоты. Хлориды образуются в результате окислительно-восстановительной реакции соляной кислоты с основными металлами, с оксидами металлов или в результате реакции нейтрализации гидроксидами металлов. Хлориды обычно хорошо растворяются в воде и диссоциируют на положительно заряженные катионы и хлорид-анионы.
Важными ионными хлоридами являются хлорид натрия и хлорид калия. Хлорид натрия из солевых отложений известен как каменная соль. Лишь небольшая часть полученной каменной соли используется как поваренная соль для наших блюд и как консервант для рыбных и мясных продуктов. В химической промышленности хлорид натрия используется в качестве сырья, например производства соляной кислоты, каустической соды, хлора.
Хлорид калия и другие соли калия, полученные из него, такие как сульфат калия, являются важными минеральными удобрениями, содержащими ионы калия. Который является основным сельхозудобрением.
Органические соединения
Помимо неорганических, существует огромное количество органических соединений хлора, например хлорированные углеводороды, хлорангидриды, хлорированные ароматические соединения, такие как хлорбензол. Однако это почти исключительно антропогенные соединения, созданные человеком. В природе же существует лишь несколько органических соединений хлора.
Применение
Крупнейшими потребителями хлора являются компании, производящие этилендихлорид и другие хлорированные растворители, поливинилхлорид (ПВХ), хлорфторуглероды и оксиды пропилена. На бумажных фабриках хлор используется для отбеливания бумаги. Компании водоснабжения и водоотведения используют хлор для дезинфекции воды.
Около 30% хлора используется в химической промышленности, около 25% требуется для производства ПВХ, 20% для очистки воды, 15% используется в растворителях и около 10% в отбеливателях.
Этот элемент также необходим для производства лекарств, силиконов и полимеров. Хлор также входит в состав бытовых отбеливателей, средств для удаления краски, антипиренов и пестицидов.
Другие применения соединений хлора:
- в качестве пестицида (хлорбензол);
- при производстве ПВХ, полиуретана и поликарбоната, соляной кислоты, хлорной извести;
- как моющее и дезинфицирующее средство;
- при производстве красок, клеев, ионообменников и даже снотворных
Высокая реакционная способность (является активным окислителем) привела к использованию хлора в качестве отбеливателя (например, в бумажной промышленности). Сейчас в этой роли все чаще используют перекись водорода, из-за вредного воздействия хлора на окружающую среду.
Хлор используется в качестве недорогого дезинфицирующего средства для питьевой воды. Получающаяся в результате хлорноватистая кислота убивает практически все вирусы и бактерии. Так называемый хлорный эффект (депо) имеет преимущество перед другими агентами. То есть после добавления хлора в водопровод, он оказывает дезинфицирующее действие на трубопроводную сеть еще в течение длительного времени. Большинство общественных бассейнов используют хлор в качестве дезинфицирующего средства.
Строительство
В прошлом в кирпичную кладку иногда добавляли хлорсодержащий антифриз. Выцветание хлоридов на необработанных кирпичных поверхностях может быть результатом неправильного подкисления. Кладка должна быть тщательно влажной перед подкислением, а после обработки ее следует быстро и обильно промыть.
Цель состоит в том, чтобы преобразовать CaCO3 (нерастворимый в воде раствор), который уже застыл с разбавленной соляной кислотой, в растворимый и моющийся хлорид кальция.
Хлорсодержащие материалы, применяемые в строительстве и быту:
- Покрытия, плиты, фасадные, настенные и напольные покрытия, содержащие ПВХ (поливинилхлорид);
- Краски, клеи или герметики с ПВХ, полихлоропреном или другим хлорсодержащим агентом;
- Средства для снятия краски, разбавители, средства для чистки кистей, содержащие хлорированные углеводороды в качестве компонентов растворителя.
Биологическое значение
Физиологически, хлор имеет большое значение в ионной форме хлорида как минерала. Употребляется в пищу в основном в форме поваренной соли (хлорид натрия). Ежедневно человек потребляет от 3 до 12г соли, которая выводится через почки и пот.
Хлорид натрия необходим для выработки желудочной кислоты, поддержания осмоса в организме, а также для проводимости нервных импульсов.
Обнаружение
Хлорид (Cl -) может обнаружен в реакции водного раствора путем подкисления азотной кислотой с нитратом серебра. В результате образуется белый осадок хлорида серебра. В дополнение к хлоридам, этот эксперимент может также обнаружить йодиды и бромиды в разбавленной аммиачной воде (реакция комплексообразования).
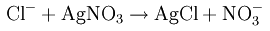
Хлор и вода
Среднее содержание хлора в морской воде составляет около 20 000 частей на миллион (2%). Концентрация в речной воде обычно составляет около 8 частей на миллион. Хлор — один из самых реактивных элементов, поэтому он легко вступает в реакцию с водой, образуя соляную кислоту и гипохлорит.
Растворимость газообразного хлора в воде составляет около 6,3 г / л при стандартных условиях. Считается, что соли хлора также легко растворяются в воде.
Как хлор может попасть в воду?
Хлор естественным образом содержится в некоторых минералах, таких как галит, сильвин и карналлит. Он не встречается в природе в свободной форме, а только в соединениях, в основном в виде хлорида натрия (поваренная соль). Поваренную соль получают в основном из галита, но ее также можно извлечь из морской воды.
Использование противообледенительных солей на дорогах и человеческих экскрементов в городских сточных водах быстро приводит к увеличению количества хлоридов в воде и почве.
Какие экологические проблемы может вызвать загрязнение воды хлором?
Концентрация хлоридов в нормальных почвах колеблется в пределах 50-2000 ppm. Самые высокие концентрации соли можно найти в засушливых и полузасушливых районах, а также в районах, расположенных недалеко от моря.
Растения поглощают хлорид через свои корни, а газообразный хлор через надземные части растения. У растения часто наблюдается скопление хлоридов в цитоплазме. Содержание хлора в растениях обычно составляет около 2000-20 000 частей на миллион. Некоторые деревья, такие как чинары или дубы, могут спокойно переносить относительно высокие концентрации солей хлора в почве.
В водных процессах часто происходят взаимодействия между хлоридом и железом, что имеет место, например, в фотохимических процессах. Также интересно, что хлорид натрия в частицах морской соли может реагировать с оксидами азота, образуя атомы хлора, которые могут разрушать озон.
Хлор оказывает токсическое действие на рыбу, смертельная концентрация при которой умирает около 50% популяции составляет около 293 частей на миллион. Соединения хлора также могут быть токсичными и очень опасными для окружающей среды.
Опасность для здоровья
При попадании на слизистые оболочки, образуются хлорноватистая и соляная кислоты. В зависимости от концентрации, вдыхание приводит к раздражению слизистых оболочек, кашлю и одышке, а также к удушью.
Попадание жидкого хлора может вызвать ожоги как слизистых оболочек, так и кожи.
Газообразный хлор крайне токсичен при вдыхании, раздражает дыхательные пути, глаза, кожу и пищеварительный тракт. Вызывает повреждение легких с тяжелыми хроническими последствиями, различные сердечно-сосудистые заболевания. Концентрация хлора около 0,5% в воздухе смертельна для человека. Концентрация около 0,001% уже может вызывать симптомы отравления.
Одно из научных исследований установило, что хлорированная вода увеличивает риск рака мочевого пузыря на 35 процентов. Плавание в хлорированной воде увеличивает опасность уже на 57 процента. Негативные эффекты зависят от концентрации хлора, продолжительности и частоты приема, а также от состояния здоровья человека.
Техника безопасности
Хранить контейнеры, содержащие хлор, плотно закрытыми в хорошо проветриваемом месте, вдали от открытого огня, тепла и солнечного света, а также влаги. При входе в помещение с газообразным хлором всегда надевать защитные респираторы.
Замена баллона с газообразным хлором возможна только при защите рук (защитные перчатки) и органов дыхания (полнолицевая маска с кислородным фильтром или автономный дыхательный аппарат). После каждой замены баллона необходимо проверять герметичность фитингов и предохранять баллоны от опрокидывания (фиксация на кронштейне).
Первая помощь при отравлении хлором
- При попадании на одежду: немедленно снять загрязненную одежду.
- После вдыхания: вынести пациента на свежий воздух, при возможности дать подышать чистым кислородом. Немедленно доставить в больницу.
- При попадании на кожу: немедленно промыть водой с мылом, в случае ожога — наложить стерильную повязку. Немедленная транспортировка в больницу.
При попадании в глаза: промыть под проточной водой в течение 10–15 минут с широко открытым веком. Затем немедленно обратиться к офтальмологу.
Экология
Использование многих продуктов, содержащих хлор, экологически сомнительно. С одной стороны, электролитическое производство хлора требует больших затрат энергии. Однако гораздо важнее то, что многие продукты, содержащие хлор, могут нанести вред окружающей среде и здоровью человека.
Причина заключается в том, что из-за недостатка природных органических соединений хлора очень немногие микроорганизмы специализируются на разложении этих соединений в ходе эволюции. Следствием этого является то, что эти неприродные соединения часто остаются в окружающей среде в течение очень долгого времени, поскольку они химически очень стабильны. Если соединения хлора затем попадают в пищевую цепь, то накапливаются в организме в конечных звеньях цепи (биоаккумуляция).
При утилизации хлорорганических соединений и пластиковых отходов из ПВХ образуются очень ядовитые диоксины и другие ядовитые соединения хлора, загрязняющие окружающую среду.







