Серная кислота представляет собой бесцветную вязкую жидкость. Относится к минеральным кислотам и к 20 наиболее важным химическим веществам современной химической промышленности. Представляет собой маслянистую, бесцветную, очень агрессивную жидкость.
Описание
Серная кислота с эмпирической формулой H2SO4 является сильной неорганической кислотой.
Концентрированная серная кислота является мощным окислителем и обладает гигроскопическим эффектом и поэтому может использоваться для сушки газов и жидкостей.
100% (чистую) серную кислоту готовят путем введения триоксида серы до тех пор, пока кислота не станет безводной. Серная кислота может связывать триоксид серы в больших количествах, а получающаяся жидкость называется олеумом (раствор серного ангидрида в 100% серной кислоте), из-за своей высокой вязкости. Олеум состоит из смеси серной и полисерной кислот (H2S2O7, H2S3O10 и т.д.).
Разбавление концентрированной серной кислоты водой приводит к моментальному выделению тепла. При разбавлении необходимо вводить в воду кислоту тонкой струйкой, а не наоборот (НЕЛЬЗЯ ЛИТЬ ВОДУ В КОНЦЕНТРИРОВАННУЮ СЕРНУЮ КИСЛОТУ)! Иначе это может привести к взрывному испарению воды и неконтролируемому разбрызгиванию жидкости.
При растворении перманганата калия в серной кислоте образуется темно-зеленая маслянистая жидкость (димангангептоксид), которая является мощным окислителем. В ней моментально обугливаются органические вещества, такие как древесина, а при добавлении ацетона или другого воспламеняющегося вещества происходит самовоспламенение.
Свойства
При растворении в воде вызывает бурную реакцию с генерированием большого количество тепла, действуя как абсорбент. И хотя не является легковоспламеняющимся соединением, но может генерировать кислород для сжигания других материалов.
Взрывается при контакте с пара-нитротолуолом и перманганатом калия. Это соединение очень опасно соединять с бромистыми карбидами, хлоратами и металлическими порошками.
При смешивании его с хлорной кислотой, получается соляная кислота.
Взаимодействие с металлами
Разбавленная серная кислота реагирует с основными металлами с образованием водорода и соответствующих солей металлов. В итоге получаются сульфаты (соли серной кислоты):
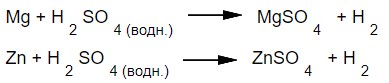
Разбавленная серная кислота не реагирует с медью. Только концентрированная (безводная) реагирует с металлом, но не с выделением водорода, а с образованием сульфата меди, диоксида серы и воды:

Драгоценные металлы золото и платина, а также железо и свинец не подвергаются воздействию концентрированной серной кислоты.
Чистая, 100% серная кислота растворяет газообразный триоксид серы SO3 с образованием дисульфокислоты:
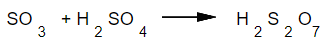
Производство
Производство серной кислоты алхимиками предположительно восходит к 13 веку. С использованием сульфата железа или меди получали дымящую серную кислоту, а при сжигании серы с селитрой или нитратом калия — разбавленную.
Оба варианта производства были описаны Андреасом Либавиусом (родился около 1540 года) в его опубликованной в 1597 году работе « Алхимия».
С 1774 года серную кислоту стали производить в промышленном масштабе. Смесь диоксида серы, воздуха и оксидов азота нагревали до примерно 400 C. Полученная газовая смесь затем попала в свинцом футерованные, каскадные резервуары, в которых смесь опрыскивали водой и тем самым получали 60-70% серную кислоту.
Сегодня производство серной кислоты происходит в основном по контактному методу.
В современном технологическом процессе получение серной кислоты осуществляется в три этапа. На первом этапе получается диоксид серы (SO2) из элементарной серы (S) при взаимодействии с кислородом (O2) :
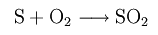
Далее диоксид серы реагирует с пятиокисью ванадия (V2O5) в качестве катализатора до триоксида серы (SO3):
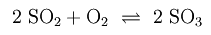
Триоксид серы является ангидридом серной кислоты. Из-за низкой растворимости в воде его вводят не непосредственно в воду, а в концентрированную серную кислоту.
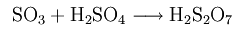
Образующаяся серная кислота непрерывно разбавляется водой.
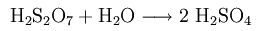
Количество произведенной серной кислоты является показателем эффективности химической промышленности страны.
Фазы развития химической промышленности:
I. Преобладающее потребление едкого натра
II. Преобладающее потребление серной кислоты
III. Преобладающее потребление хлора
Применение
Серная кислота является одним из наиболее часто используемых химических веществ. По всему миру производится более 150 миллионов тонн. Применяется:
- для производства сульфатов;
- для производства других кислот (например, плавиковой и фосфорной);
- для производства удобрений;
- для производства поверхностно-активных веществ;
- в качестве катализатора;
- как осушитель (адсорбент);
- при производстве автомобильных аккумуляторов;
- при производстве диоксида титана;
- при приготовлении косметических средств и фармацевтических препаратов, требующих процесса сульфирования, к примеру мыла.
В пищевой промышленности серная кислота используется в качестве технического вспомогательного вещества для производства модифицированного крахмала и казеина, а также для очистки питьевой воды.
В пустынных районах Соединенных Штатов используется в сельском хозяйстве для восстановления засушливых и неплодородных почв.
Опасность для здоровья
Пары этой кислоты крайне токсичны и при вдыхании могут привести к серьезному повреждению легких.
Попадание в глаза вызывает полную потерю зрения, а на кожу — серьезные ожоги.
При приеме внутрь (даже если это капля) — может привести к мучительной смерти.
Обращение с серной кислотой должно осуществляться с большой осторожностью и в соответствии с мерами промышленной безопасности.







