Азотная кислота является одной из трех самых распространенных и часто используемых кислот в химической промышленности.
В начале 20-го века азотная кислота могла быть произведена только путем взаимодействия нитрата натрия (челийская селитра) с серной кислотой.
В 1901-1902 годах немецкий химик Вильгельм Оствальд впервые разработал метод получения азотной кислоты путем окисления аммиака. До настоящего момента этот процесс производства используется крупными производителями во всем мире.
По данному технологическому процессу азотная кислота проходит три этапа. Сначала аммиак окисляется воздухом до оксида азота, который затем вступает в реакцию с кислородом с образованием диоксида азота. На заключительном этапе из диоксида азота получается азотная кислота.
1. Окисление аммиака
Аммиак окисляется в печи кислородом, в результате чего образовываются различные оксиды азота и элементарный азот.
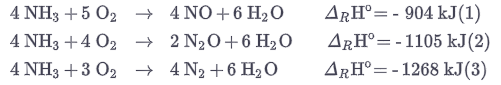
Образование оксида азота является наиболее желательным с производственной точки зрения (реакция 1). Но две другие реакции являются более благоприятными с точки зрения термодинамики, поскольку они идут с образованием тепла и энергии.
Чтобы образование оксида аммиака шло именно по реакции 1, в качестве катализатора используются платиновые сетки. Это ускоряет процесс до 0,001с и позволяет избежать других (более медленных) побочных реакций.
Температура процесса достигает 820-950 С, что заставляет наименее экзотермическую реакцию 1 протекать преимущественно по сравнению с другими реакциями.
После реакции образовавшийся оксид азота должен быть немедленно охлажден, иначе он распадется на элементы.
2. Окисление оксида азота
После охлаждения полученных газов до комнатной температуры, окись азота дополнительно окисляется атмосферным кислородом до образования двуокиси азота.

3. Реакция диоксида азота с водой
В абсорбционной колонне двуокись азота реагирует с противоточной с водой с образованием азотной кислоты и окиси азота.
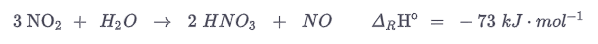
Оксид азота, образующийся в качестве побочного продукта, немедленно вступает в реакцию с избытком кислорода с образованием диоксида азота. Это снова запускает реакцию с водой до образования азотной кислоты.
Производимая в результате азотная кислота имеет концентрацию 50-69%, что является достаточным для основного промышленного использования.
Для получения концентрированного раствора азотной кислоты (от 70 до 100%), ее перегоняют в присутствии дегидратирующих веществ (например, концентрированной серной кислоты).
Поскольку реакция диоксида азота с водой представляет собой процесс диспропорционирования, в котором оксид азота всегда производится в дополнение к азотной кислоте, невозможно достичь полной конверсии оксидов азота в конечный продукт.
Поэтому отработанный технический газ на конце абсорбционной башни все еще содержит около 0,02-0,05% монооксида и диоксида азота. Они вредны для окружающей среды и поэтому должны максимально удаляться при выбросе выхлопных газов в окружающую среду.