Описание
Гидроксид натрия (каустическая сода, едкий натр, гидроокись натрия), химическая формула NaOH, представляет собой белый гигроскопичный порошок (чешуйки, гранулы). На воздухе реагирует с углекислым газом с образованием карбоната натрия и поэтому должен храниться в герметически закрытых контейнерах.
Если в воду добавить немного каустической соды, а затем перемешать, раствор нагревается. Это простой пример процесса экзотермического растворения. Противоположный эффект (эндотермическая реакция) может наблюдаться в случае растворения в воде нитрата калия или нитрата аммония.
Физические свойства
Гидроксид натрия — это белое, без запаха, очень гигроскопичное вещество. Основные примеси:
- хлорид натрия (≤ 2%);
- карбонат натрия (≤ 1,0%);
- сульфат натрия (≤ 0,2%).
Гидроксид натрия смешивается с водой во всех пропорциях, но затвердевает при 20 C, если концентрация основного вещества превышает 52% по весу. Это значение считается максимальной растворимостью в воде при 20 C. Гидроксид натрия хорошо растворяется в таких спиртах, как метанол, этанол, глицерин. Не растворяется в ацетоне и этиловом эфире.
В промышленных масштабах гидроксид натрия поставляется либо в твердой форме (блоки, чешуйки, зерна, шарики, порошок), либо в виде водных растворов различных концентрациях.
Химические свойства
Гидроксид натрия — очень гигроскопичный продукт, который быстро поглощает влагу из воздуха и в то же время фиксирует углекислый газ, с которым он образует карбонат натрия.
Растворение гидроксида натрия в воде сопровождается очень значительным выделением тепла, реакция может быть бурной! Водные растворы также выделяют тепло при разбавлении: 40% -ный или более раствор гидроксида натрия при разбавлении водой выделяет большое количество тепла, повышая температуру выше точки плавления, что может привести к спорадическим и неконтролируемым выбросам коррозионной жидкости!
Гидроксид натрия — это сильное основание, водные растворы которого, активно реагируют с кислотами.
Реакции гидроксида натрия со многими органическими или неорганическими соединениями, такими как фосфор, гидрохинон, метанол, хлороформ, сильные кислоты, хлорангидриды, ангидриды, кетоны и гликоли, могут быть бурными и даже взрывоопасными. В присутствии воды гидроксид натрия реагирует с нитроалканами, образуя соли, которые в сухом состоянии взрывоопасны. Термическое разложение гидроксида натрия при высокой температуре приводит к образованию паров оксида натрия.
Некоторые металлы, такие как алюминий, цинк, олово, свинец, а также бронза и латунь, подвергаются воздействию водных растворов гидроксида натрия с выделением водорода — очень легковоспламеняющегося и взрывоопасного газа.
До 65 C нержавеющая сталь не подвергается воздействию водных растворов гидроксида натрия, независимо от их концентрации. Некоторые специальные стали могут выдерживать температуру до 90 C. Металлы, которые лучше всего сопротивляются коррозионному действию гидроксида натрия в растворах, даже в концентрированных и горячих — это никель и некоторые никелевые сплавы.
Гидроксид натрия и его водные растворы разрушают определенные пластики, эластомеры, покрытия, но не тефлон и другие фторуглероды, поливинилхлорид, полипропилен, полиэтилен высокой или очень высокой плотности.
Производство
Реакция карбоната натрия с гидроксидом кальция с получением гидроксида натрия и карбоната кальция:
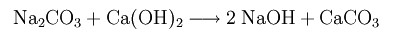
Слабо растворимый карбонат кальция отфильтровывают. Фильтрат содержит легко растворимый гидроксид натрия.
В настоящее время едкий натр промышленно получают при хлорно-щелочном электролизе. Исходными материалами являются хлорид натрия и вода, а на выходе — раствор гидроксида натрия, водород и хлор.
В лаборатории гидроксид натрия может быть получен реакцией элементарного натрия с водой с образованием едкого натра и водорода.
Использование
- Производство различных мыл, переработка резины, нефтяная промышленность, стекольная промышленность, фармацевтическая промышленность, ветеринария и пр.
- Целлюлозно-бумажная промышленность (производство, отбеливание, водоподготовка и др.);
- Металлургическая и алюминиевая промышленность (производство алюминия и других металлов из руд);
- Пищевая промышленность (мойка бутылок, материалов и оборудования, химический пилинг, пищевая добавка E524);
- Лабораторные анализы (реактив для проб);
- Приготовление красителей;
- Производство целлюлозы;
- Производство смазок;
- Очистка масла и нефти;
- Переработка бокситов (при производстве алюминия);
- Синтез различных химических веществ: гипохлорит натрия, фосфат натрия, сульфид натрия, алюминат натрия;
- Производство муравьиной кислоты;
- Производство деминерализованной воды;
- Очистка водопроводных труб;
- Травление латунных, никелевых, серебряных и медных пластин;
- Очистка резервуаров из нержавеющей стали.
Гидроксид натрия также используется в области возобновляемых источников энергии (катализатор для производства биодизеля из растительных масел и хранения солнечной энергии в химической форме). Другие области применения — регенерация каучука, растворение казеина при производстве пластмасс, рафинирование растительных масел.
Воздействие на организм человека
Гидроксид натрия сжигает кожу, поскольку он активно реагирует с влагой кожных и слизистых покровов. Попадание в глаза может вызвать серьезное повреждение глаз и даже слепоту. При проглатывании возможна перфорация пищевода, желудка и смерть.
Техника безопасности при работе с гидроксидом натрия
Информация и обучение рабочих
Проинструктируйте персонал о рисках, связанных с веществом, о мерах предосторожности, которые необходимо соблюдать, о мерах гигиены, которые необходимо принять, а также о чрезвычайных мерах, которые необходимо принять в случае аварии. Обучите операторов обращению со средствами пожаротушения.
Соблюдайте строгую личную гигиену и гигиену одежды: тщательное мытье рук (мыло и вода) после работы и полная смена рабочей одежды. Рабочая одежда очищается после каждой смены и при необходимости заменяется. Ни при каких обстоятельствах сотрудники не должны покидать предприятие в рабочей одежде и обуви. На рабочем месте нельзя курить, пить и употреблять пищу.
Правила хранения
- Храните в мастерских (цехах) количество, не превышающее количество, необходимое для повседневной работы.
- Избегайте попадания материала на кожу и в глаза.
- Избегайте вдыхания пыли (гидроксид натрия в твердой форме) или паров, аэрозолей (гидроксид натрия в водных растворах). Во всех случаях необходимо обеспечить приточно-вытяжную вентиляцию, отсасывание пыли, паров или аэрозолей у источника их выброса в соответствии с действующими нормативами.
- Регулярно оценивайте воздействие на сотрудников гидроксида натрия, присутствующего в воздухе.
- Устраните любой источник заражения путем регулярной уборки помещений и рабочих мест.
- Выполняйте замену, перенос, разбавление, растворение таким образом, чтобы избежать локального перегрева, брызг жидкости и образования паров / туманов / аэрозолей.
- Для разбавления водой (экзотермическая реакция) медленно и постепенно вливайте гидроксид натрия в воду в небольших количествах при перемешивании. НИКОГДА НЕ НАЛИВАЙТЕ ВОДУ на твердый гидроксид натрия или водные растворы гидроксида натрия!
Средства индивидуальной защиты (СИЗ)
Их выбор зависит от условий труда и оценки профессиональных рисков.
- Устройства защиты органов дыхания: если необходимо использовать фильтрующее устройство, оно должно быть оснащено фильтром типа P2.
- Перчатки: натуральный каучук, бутилкаучук, неопрен, поливинилхлорид.
- Защитная одежда: когда их использование необходимо (в дополнение к рабочей одежде), их выбор зависит от физического состояния вещества. Только производитель может подтвердить эффективную защиту одежды от опасностей, связанных с этим веществом. В случае использования многоразовой одежды необходимо строго соблюдать инструкции производителя.
- Защитные очки: только паспорта безопасности на изделие может дать информацию о характере защиты глаз.
Места хранения
Храните гидроксид натрия в прохладных помещениях (рекомендуемая температура от 15 до 25 C) и при постоянной вентиляции. Беречь от тепла, горячих поверхностей, всех источников возгорания (искры, открытое пламя, солнечный свет и т.д.), воздействия кислот и несовместимых продуктов.
Хранение гидроксида натрия обычно осуществляется в емкостях из нержавеющей стали, углеродистой стали, никеля, полиэтилена и т.п. Не используйте емкости из алюминия, меди, цинка и их сплавов.
Во всех случаях рекомендуется проконсультироваться с поставщиком вещества или материала для хранения на предмет хорошей совместимости предполагаемого материала и хранимого вещества. Тщательно закрывайте контейнеры и промаркируйте их в соответствии с правилами безопасного хранения. Обеспечьте внутри или в непосредственной близости от помещения / складского помещения средства пожаротушения, подходящие для всех хранящихся продуктов.
Действия при разгерметизации тары
В случае случайного разлива твердого гидроксида натрия следует избегать подметания. Соберите продукт, пропылесосив его промышленным пылесосом. В случае случайного разлива водных растворов гидроксида натрия соберите продукт, промокнув абсорбирующим и нейтрализующим материалом. Загрязненную поверхность необходимо промыть большим количеством воды.
В случае значительного разлива проветривайте помещение и эвакуируйте персонал.
Пожарная безопасность
Гидроксид натрия и его водные растворы — негорючие вещества.В присутствии других продуктов могут образоваться легковоспламеняющиеся или даже взрывоопасные вещества (например, в присутствии определенных металлов, трихлорэтилена или тетрахлорэтана), что создает риск возгорания или даже взрыва.
Кроме того, при растворении или разбавлении гидроксида натрия выделяется большое количество тепла, которое может стать причиной пожара.







