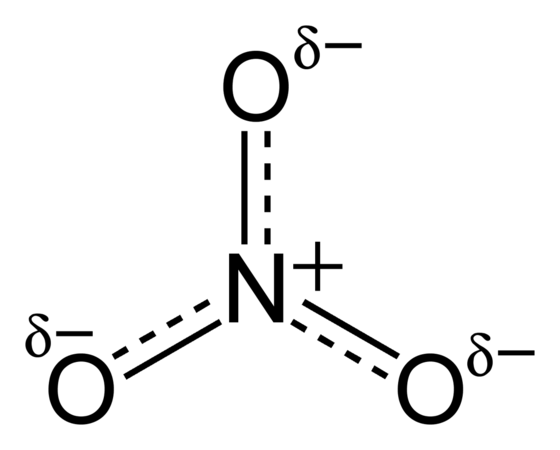
Соли азотной кислоты называют нитратами, которые в основном используются в качестве удобрений в сельском хозяйстве и как окислители, например при производстве фейерверков или в химическом синтезе.
Соли азотной кислоты являются ионными соединениями, состоящие из положительно заряженных ионов металлов.
Нитраты образуются при взаимодействии металлов, оксидов, карбонатов или гидроксидов металлов с разбавленной азотной кислотой.
Свойства и использование нитратов
Нитраты в основном представляют собой бесцветные кристаллические твердые вещества, которые разлагаются под воздействием термической нагрузки. Нитраты щелочных металлов образуют нитриты и кислород, а нитраты тяжелых металлов превращаются в оксиды.
Как в случае нитрата аммония, термическое разложение может происходить со взрывом. Термическое разложение нитратов играет решающую роль в воспламенении фейерверков.
Нитраты часто являются хорошими окислителями. В отличие от расплавов, водные растворы не обладают окислительным действием.
Удобрения, содержащие нитраты, используются для покрытия азотного дефицита растений. Чтобы предотвратить слишком быстрое вымывание растворимых нитратов из почвы, они используются в соответствующих комбинированных удобрениях, которые выделяют ионы нитрата очень медленно.
Важным сырьем для этих удобрений является нитрат натрия, нитрат калия, нитрат кальция и аммиачная селитра.
Обнаружение нитрат-иона
Нитраты не могут быть обнаружены реакциями осаждения. По этой причине были разработаны тест-полоски, которые вызывают характерные цветовые реакции с нитрат-ионами. Другой простой способ обнаружения нитрат-ионов — это так называемый кольцевой тест.
Раствор, который нужно проверить, смешивают с несколькими каплями раствора сульфата железа (II). Раствор покрывают концентрированной серной кислотой (осторожно!). Серная кислота имеет более высокую плотность, чем водный раствор, и оседает на дне пробирки. На границе раздела образуется кольцо коричневого цвета.
Нахождение в природе и применение
Нитрат калия встречается в природе редко и должен производиться из нитрата натрия. Он также является важным компонентом черного порошка, смеси 10% мелкоизмельченной серы, 15% молотого древесного угля и 75% нитрата калия. Он использовался с XII века в Китае и с XIV века в Европе в качестве взрывчатого вещества и метательного вещества в пушках и мушкетах.
Приблизительно 2300 литров газообразных продуктов реакции образуются из одного килограмма черного пороха.
Нитрат калия используется в салютах для осветительных приборов и как компонент холодных смесей.
Аммиачная селитра — важный компонент удобрений. Однако из-за его взрывоопасного действия его нельзя использовать в чистом виде, а только в смесях с карбонатом кальция.
Другой важный нитрат — это нитрат серебра, который можно получить путем реакции концентрированной азотной кислоты с серебром. Полученный таким образом нитрат серебра используется для гальванического серебряного покрытия. Он также используется для удаления новообразований и в качестве важного реагента в аналитической химии, например для обнаружения галогенид-ионов (хлорид, бромид, йодид).
Реакция обнаружения основана на том, что раствор нитрата серебра добавляют по каплям к кислому раствору пробы. В присутствии упомянутых галогенидов образуется галогенид серебра, который плохо растворяется в воде и выпадает в виде осадка. Хлорид серебра белый, бромид серебра слегка желтый, а йодид серебра интенсивно желтый.