Диссоциация
Процесс отделения ионов от их кристаллической решетки называется диссоциацией.
Если в воду добавить крупинки хлорида натрия, вода станет мутной только на короткое время. Когда вы прекращаете перемешивание, похоже, что хлорид натрия исчезает, и даже через очень долгий период времени вы не можете увидеть никаких посторонних включений на дне сосуда. Хлорид натрия — это ионное соединение, состоящее из положительно заряженных катионов натрия и отрицательно заряженных анионов хлорида с химической формулой NaCl.
Молекулы воды состоят из атома кислорода, который образует две ковалентные связи с двумя атомами водорода. Две связи не находятся на прямой линии, а образуют угол примерно 104 градуса. Атомы водорода находятся на концах, а атом кислорода — на углу. Кроме того, кислород имеет более высокую электроотрицательность, чем водород, что означает, что электроны связывающих электронных пар неравномерно распределены между двумя атомами связи.
По этой причине частично отрицательный заряд образуется на стороне атома кислорода, а частично положительный заряд образуется на концах с атомами водорода.
Слегка положительно заряженные области молекул воды притягиваются к слегка отрицательной области других молекул воды или к заряженным частицам, таким как ионы. Если ионное вещество вводится в воду, слегка отрицательная область молекул воды притягивается к катионам, а слегка положительно заряженная область притягивается к анионам. Небольшой размер молекул воды позволяет им полностью окружать ионы. Во время этого процесса гидратации ионная связь соли, такой как хлорид натрия, распадается на отдельные катионы Na + и анионы Cl — , которые переносятся от кристаллической решетки. Хлорид натрия и вода составляют одноводный раствор с водой в качестве растворителя и хлоридом натрия в качестве растворенного вещества.
Электролиты
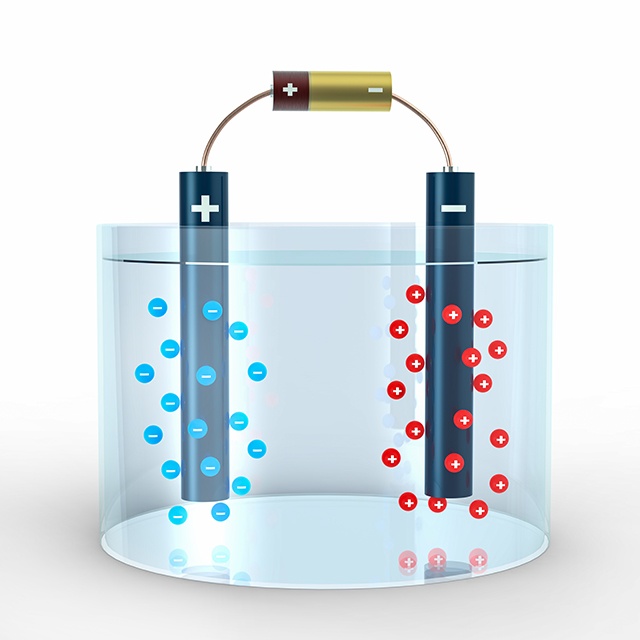
Вещество, содержащее свободно движущиеся ионы, называется электролитом. Если в воду добавить хлорид меди (CuCl2), кристаллы начинают диссоциировать, и получается водный раствор с ионами Cu 2+ и Cl — , которые могут свободно перемещаться между молекулами воды. Что происходит, когда этот раствор подвергается воздействию электрического поля? Мы можем подвергнуть водный раствор хлорида меди воздействию электрического поля, поместив две пластины из электропроводящего материала с двух сторон сосуда и подключив эти пластины к источнику напряжения. Левая пластина подключается к положительному полюсу источника напряжения, а правая пластина — к отрицательному полюсу, что создает электрическое поле.
Как только электрическое поле сформировано, на заряженные ионы действуют силы. Положительно заряженные катионы притягиваются к отрицательно заряженной пластине, отрицательно заряженные анионы — к положительно заряженной пластине. В результате этого движения ионы неравномерно распределяются по сосуду, что также приводит к образованию электрического поля, направленного против внешнего поля источника напряжения. В отличие от электронов, которые могут попасть в пластину, движение ионов прекращается, когда они касаются пластин. Как только электрическое поле, создаваемое ионами, уравновешивает поле внешнего источника напряжения, силы больше не действуют на ионы, и их движение прекращается.
Пластины из электропроводящего материала называются электродами. Электрод, подключенный к отрицательному полюсу источника напряжения, называется катодом, электрод, подключенный к положительному полюсу, называется анодом.
В электролите положительно заряженные ионы (катионы) притягиваются к отрицательно заряженному катоду, а отрицательно заряженные ионы (анионы) — к положительно заряженному аноду.
Окислительно-восстановительная реакция
Как только ион входит в контакт с одним из электродов, запускаются химические реакции. На положительно заряженном электроде электроны покидают электролит, как только к нему прикасается анион. Анион высвобождает один или несколько электронов, что приводит к увеличению его степени окисления. Таким образом окисляется анион. Катионы захватывают электроны на отрицательно заряженном электроде (катоде), что приводит к снижению их степени окисления. Таким образом, катионы восстанавливаются.
Электроны, переносимые анионами на анод, покидают там электролит. Затем они «перекачиваются» от источника напряжения на катод. Там электроны снова входят в электролит, передаваясь катионам. Это замыкает электрическую цепь, и через электролит течет постоянный ток. Этот процесс называется электролизом.
Электропроводность электролита зависит от количества и подвижности ионов, а также от их заряда. Во время прохождения электрического тока через электролит ионы превращаются в незаряженные атомы за счет поглощения или высвобождения электронов и, таким образом, выводятся из электролита. Это снижает количество ионов и, следовательно, проводимость электролита.